La electroquímica es una rama de la química que estudia la transformación entre la energía eléctrica y la energía química.
En 1780, Luigi Galvani descubrió que cuando dos metales diferentes (cobre y zinc, por ejemplo) se ponían en contacto y, a continuación, ambos tocaban diferentes partes de un nervio de un anca de rana, hacían que se contrajesen los músculos de dicha extremidad. Llamó a este fenómeno "electricidad animal" y sirvió de modelo para el diseño de la primera pila. La pila voltaica inventada por Alessandro Volta en 1800 es similar a la pila galvánica y se baso en la creación de la electricidad de las anguilas. Estos descubrimientos allanaron el camino para las baterías eléctricas..
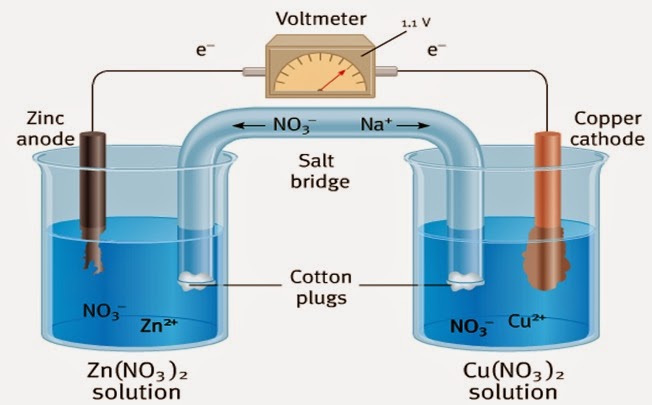
La celda galvánica o celda voltaica, es una celda electroquímica que obtiene la energía eléctrica a partir de reacciones redox espontáneas que tienen lugar dentro de la misma. Una celda galvánica consta de dos semipilas (en su forma más simple, cada semipila consta de un metal (electrodo) y una solución de una sal del metal). La solución de la sal contiene un catión del metal y un anión para equilibrar la carga del catión. En esencia, la semipila contiene el metal en dos estados de oxidación, y la reacción química en la semipila es una reacción redox, escrito simbólicamente en el sentido de la reducción como:
M n+ (especie oxidada) + ne-
M (especie reducida)
- Cátodo:
Los electrones que vienen del cable se unen con el cobre en disolución y genera una capa de cobre en el
cátodo. Esta reacción entre el cobre (+2) y los electrones genera aniones nitratos que van al puente salino.
La reacción que se daría son las de reducción y en nuestro caso sería:
Cu+2 +2e-
--> Cu0 Cu(NO3)2 --> Cu+2 + 2 NO3
-
- Puente salino:
Los iones del puente salino no reaccionan con los otros iones de la celda ni con el material de los
electrodos. A medida que se produce la oxidación y la reducción de los electrodos, los iones del puente
salino emigran para neutralizar la carga en los compartimientos de la celda.
Los aniones emigran hacia el ánodo y los cationes hacia el cátodo. De hecho, no se producirá un flujo medible de electrones a través del circuito externo, a menos que se proporcione un medio para que los iones emigren a través de la solución de un compartimiento al otro, con lo que el circuito se completa.
- Ánodo:
El zinc pierde dos electrones para reaccionar con los aniones nitratos que salen del puente salino que estabiliza la creación de cationes Zn para dar más durabilidad a la pila galvánica. La reacción que se daría son las de reducción y en nuestro caso sería:
Zn0 --> Zn+2 +2e- Zn+2 + 2 NO3 --> Zn(NO3)2
Por último explicar que esto se espontáneamente debido a los potenciales de oxidación y reducción del zinc y del cobre, que generan un potencial positivo.
E(Zn0/ Zn+2)= 0.76 V E(Cu+2/Cu0)=0.34 V
E(pila)= E(cátodo) – E(ánodo)= 0.34 – (-0.76) = 1.10 V
- Si E = (+) el proceso es espontáneo
- Si E = (-) el proceso no es espontáneo.
- Si E = 0 entonces el proceso está en equilibrio
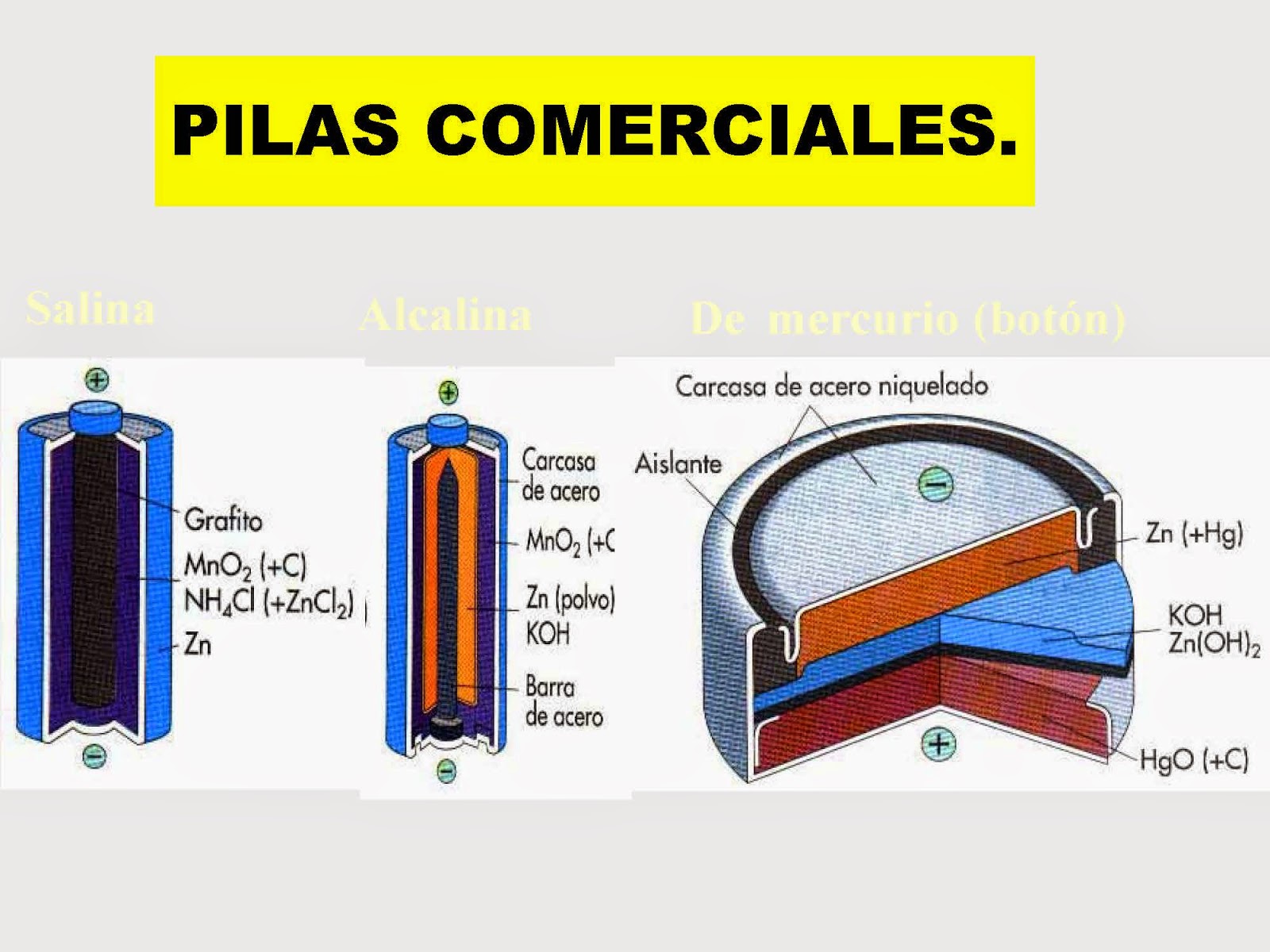
- Pilas, baterias
- Joyería (baño de oro o de plata)
- Joyería (baño de oro o de plata)
- Industria del metal
- Galvanizado
- Zincado
- Niquelado
- Industria del automóvil: (Cataforesis)
EXPERIMENTOS EN CASA
- Pila de limones (Guía)
- Pila de manzanas (Parecida a la pila de limones)
- Pila de patatas (Parecida a la pila de limones)
- Pila de monedas (Guía)
No hay comentarios:
Publicar un comentario